Im Jahre 1980 wurden zu Lasten der gesetzliche Krankenversicherung (GKV) knapp 7 Mrd. Euro für Arzneimittel aus Apotheken umgesetzt. Im Jahre 2007 lag der Umsatz bereits bei 24,8 Mrd. Euro. Und für das vergangene Jahr werden diese Zahlen berichtet: Die Ausgaben der gesetzlichen Krankenversicherung für Arzneimittel sind 2016 um 3,9 Prozent auf 38,5 Milliarden Euro gestiegen. 3,9 Prozent mehr bedeuten in diesem Fall 1,44 Mrd. Euro mehr als noch 2015. Grundlage dieser Zahlen ist der seit 1985 jährlich veröffentlichte Arzneiverordnungs-Report der AOK, herausgegeben vom Wissenschaftlichen Institut der AOK (WIdO). Der Report wird gemeinsam mit der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) erarbeitet. Wie kommt es zu einem solchen Preisanstieg? Diese Frage wird über eine Komponentenzerlegung beantwortet, durch die man die Preis-, Mengen- und Strukturentwicklung differenziert betrachtet.
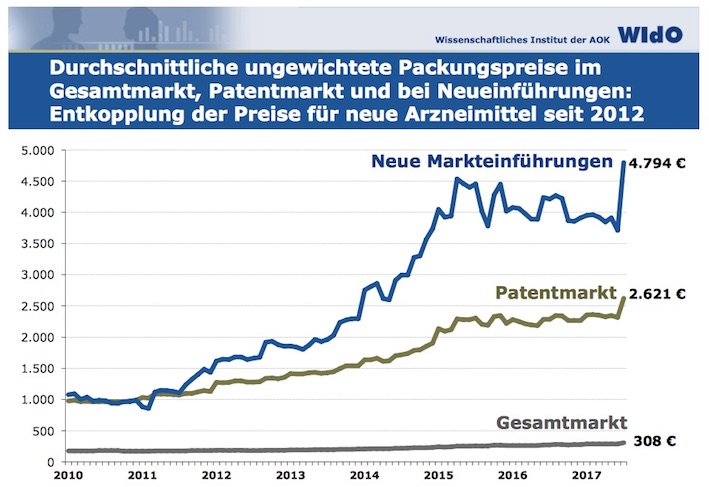
Der wichtigste Befund: Es ist vor allem der Preisanstieg bei den patentgeschützten Medikamenten, der die Steigerung erklärt. Deutlich wird das unter anderem daran, dass das teuerste eine Prozent aller Arzneimittel im Jahr 2016 pro Verschreibung mindestens 3.979 Euro gekostet hat – zehn Jahre zuvor waren es nur 950 Euro gewesen. „2016 wurden mehr, aber vor allem auch teurere Arzneimittel verordnet. Hauptursache dafür war die überproportionale Kostensteigerung bei den patentgeschützten Wirkstoffen“, so wird Ulrich Schwalbe, der Mit-Herausgegeber des Arzneiverordnungs-Reports, in den Presseunterlagen zur neuen Ausgabe zitiert. Und Deutschland muss als Land der hohen Preise bezeichnet werden, denn patentgeschützte Arzneimittel sind hier besonders teuer. In Ländern wie Österreich oder den Niederlanden, deren Wirtschaftskraft mit Deutschland vergleichbar ist, seien die öffentlich bekannten Listenpreise etwa 20 Prozent günstiger.
In dem neuen Report werden einige Fragezeichen an die bisherige Gesundheitspolitik gesetzt. So beklagt. So kritisiert Ulrich Schwalbe die Politik dahingehend, dass geplante Regeln zur Eindämmung des konstanten Kostenanstiegs fallengelassen wurden. Als Beispiel wird das Vorhaben genannt, ältere patentgeschützte Arzneimittel wie neue auf ihren Zusatznutzen und angemessene Preise zu überprüfen. Auch eine geplante Umsatzschwelle für neue Mittel sei nicht umgesetzt worden.
Verstärkt wird die Entwicklung hin zu hohen Preisen für patentgeschützte Arzneimittel dadurch, dass Pharmafirmen in Deutschland den Preis ihres patentgeschützten Produkts in den ersten zwölf Monaten nach dem Marktzugang noch immer frei festlegen können. Erst nach einem Jahr gilt ein zwischen dem Anbieter und dem GKV-Spitzenverband auf der Grundlage der Frühen Nutzenbewertung (vgl. dazu die Erläuterungen des Gemeinsamen Bundesausschusses: Die Nutzenbewertung von Arzneimitteln gemäß § 35a SGB V) ausgehandelter Erstattungspreis. Die Forderung aus dem Kassenlager an dieser Stelle: Um der Hochpreisstrategie der Pharmafirmen zu begegnen, sollten sich die Erstattungspreisverhandlungen stärker am Zusatznutzen eines Wirkstoffs orientieren und die verhandelten Preise rückwirkend ab dem ersten Tag des Marktzugangs gelten.
Ein weiteres Problemfeld: Patienten könnten zudem gefährdet sein, denn immer mehr Mittel kämen per Schnellzulassung auf den Markt und würden nicht ausreichend getestet. Der Arzneiverordnungs-Report diagnostiziert einen Trend zu mehr beschleunigten Zulassungsverfahren. Man muss an dieser Stelle darauf hinweisen, dass das nicht per se ein „schlechtes“ Unterfangen ist, denn das Ziel beschleunigter Zulassungsverfahren ist es, neue Wirkstoffe für die medikamentöse Behandlung seltener Erkrankungen möglichst schnell für betroffene Patienten zugänglich zu machen. Die Schattenseite: Gleichzeitig kommen dadurch aber immer mehr Produkte ohne eine ausreichende Datenbasis zu Nutzen und Risiken für die Patienten auf den Markt.
Dieses Instrument wird offensichtlich immer stärker genutzt: In Deutschland betraf das im Jahr 2016 bereits fast jedes dritte neue Arzneimittel. Im Jahr 2011 waren es noch unter zehn Prozent.
Die Kritik der Kritiker: Ist der Marktzugang erst einmal erfolgt, kommen viele Pharmaunternehmen ihrer Verpflichtung nach weiteren Daten nicht ausreichend nach, um den Bewertungsprozess voranzutreiben.
Wie wichtig das aber ist, wird am Beispiel des Multiple-Sklerose-Mittels Tecfidera illustriert: Auf den Markt sei es in Deutschland mit einem um 80 Prozent höheren Preis als etwa in Holland gekommen. Danach erfolgte die Bewertung des Nutzens anhand gesetzlicher Vorgaben – mit dem Ergebnis, dass das Mittel keinen Zusatznutzen gegenüber vergleichbaren Medikamenten habe Der Hersteller habe dann in Preisverhandlungen mit den Kassen eine Senkung um fast 50 Prozent akzeptiert – aber erst nach einem Jahr. 104 Millionen Euro allein für dieses eine Mittel hätten die Kassen sparen können, wenn das Gesetz den günstigeren Preis auch rückwirkend festlegen würde.
Dass ausreichend Studien gerade im Bereich der Schnellzulassung so wichtig sind, ergibt sich auch aus dem Zusammenhang, dass hier oftmals die Wirksamkeit über- und Risiken unterschätzt werden, was für die Patienten zu einem echten Problem werden kann, wenn es zu wenig Studien darüber, wie diese Medikamente wirklich wirken, gibt.
An dieser Stelle wird seitens der AOK ein von der Pharmaindustrie zu finanzierender Fonds, um Arzneimittelstudien zu bezahlen, gefordert. Man dürfe die Überprüfung der neuen Medikamente nicht den Herstellern überlassen.
Wer sich für detaillierte Daten zum deutschen Arzneimittelmarkt interessiert, der wird hier fündig:
➔ Wissenschaftliches Institut der AOK (WIdO) (2017): GKV-Arzneimittelindex. Preisentwicklung auf dem Arzneimittelmarkt bis August 2017, Berlin 2017
Auch in anderen Ländern – die ähnlich wie Deutschland ein „attraktives Preisumfeld“ für die Pharmafirmen ermöglichen, gibt es die beschriebenen problematischen Preisentwicklungen. Und Reaktionen seitens der Politik. Ein Beispiel hierfür wäre der Artikel US-Abgeordnete nehmen Pharmakonzerne wegen Arzneipreisen ins Visier: »Die Preise für Medikamente gegen Multiple Sklerose sollen sich seit 2004 verfünffacht haben: US-Demokraten haben nun Ermittlungen gegen mehrere Pharmakonzerne angestoßen – auch gegen deutsche Firmen.« Konkret geht es in diesem Fall um die deutschen Arzneimittelhersteller Merck und Bayer. »Für die Merck ist das MS-Mittel Rebif mit einem Jahreserlös von zuletzt 1,74 Milliarden Euro bislang das mit Abstand umsatzstärkste Medikament. Bayer setzte mit seinem MS-Mittel Betaferon im vergangenen Jahr 734 Millionen Euro um, davon 386 Millionen in den USA. Das Mittel liegt damit auf Platz sechs der umsatzstärksten Pharmaprodukte der Leverkusener.«
Der Hintergrund verweist auf ein strukturelles Dilemma, wenn man bei den Preisbildungs- bzw. besser: Preissetzungsprozessen nicht oder zu wenig regulatorisch eingreift, mit dem man auch wie dargestellt in abgeschwächter Form in Deutschland konfrontiert ist: »Die durchschnittlichen Kosten einer MS-Therapie stiegen laut Nationaler Multiple-Sklerose-Gesellschaft von 16.000 Dollar 2004 auf 78.000 Dollar im vergangenen Jahr. Die USA sind der mit Abstand wichtigste Markt für die Pharmaindustrie – sie erzielt dort 40 Prozent ihrer Umsätze. Zudem verdienen die Unternehmen dort überdurchschnittlich gut, weil ihnen bei der Preisgestaltung kaum Grenzen gesetzt sind.«
Quelle der Abbildung: WIdO, Pressekonferenz „Arzneiverordnungs-Report 2017“ ‒ 4. Oktober 2017 in Berlin